Як Україні стати Меккою для проведення досліджень нових ліків

Україна має всі шанси перетворитися на центр проведення досліджень нових ліків для міжнародних фармацевтичних компаній. Що заважає це зробити, і що в України вже є для того, щоб стати успішною у цій сфері
Коли звичайні ліки не допомагають у боротьбі з важкою хворобою, чи не єдиною можливістю отримати необхідне лікування може бути участь у клінічних випробуваннях нових ліків. Тож, від того, наскільки успішною буде Україна в залученні нових досліджень, прямо залежить кількість пацієнтів, які отримають шанс на одужання.
Крім користі для пацієнта, дослідження приносять значну користь для економіки країни. Спробуємо з’ясувати, що необхідно для успіху клінічних випробувань в Україні, та спочатку — про саме явище клінічних випробувань.
Що таке клінічне випробування
Щоб зрозуміти, чи є нові ліки безпечними для людини, і чи допомагають вони у лікуванні хвороб, потрібно провести їх клінічне випробування.
Для мінімізації загрози життю людини такі випробування проводяться у медичних установах відповідно до затверджених протоколів — документів, що фактично є покроковими інструкціями з належного проведення дослідження. В основі процесу завжди лежить дозвіл компетентного органу, який надається, якщо очікувана користь від дослідження виправдовує ризик.
Зазвичай клінічні випробування діляться на чотири фази. У ході перших трьох фаз з’ясовуються безпечні дози та побічні ефекти препарату, оцінюється та підтверджується його ефективність.
Четверта фаза дозволяє зібрати додаткову інформацію про ризики та переваги препарату, а також визначити оптимальне дозування. Переважно вже після успішного проведення перших трьох фаз нові ліки схвалюються для застосування і потрапляють на полиці аптек.
Еволюція клінічних випробувань
Згадки про перше клінічне випробування датовані шостим сторіччям до нашої ери. Біблійна Книга Даниїла розповідає про царя Навуходоносора, який наказав юнакам у своєму палаці вживати лише м'ясо та вино. Він вважав, що така дієта дозволить їм бути в доброму здоров'ї.
Однак Даниїл не захотів вживати царську їжу, тому йому та його друзям дозволили протягом десяти днів їсти виключно горох, квасолю і воду. Після закінчення експерименту виявилося, що його учасники виглядали і почували себе краще ніж ті, хто вживав їжу царя, тому їм дозволили продовжити свою дієту.
Таким чином, можливо вперше в історії людства, дослідження за участі людей стало основою рішення у сфері суспільного здоров’я.
За тисячі років клінічні випробування еволюціонували та дозволяють отримувати ліки від раніше невиліковних хвороб. Так, цього року було успішно завершено дослідження препарату, що допомагає лікувати складні форми розсіяного склерозу. Інший революційний препарат шляхом стимулювання імунної системи людини вже зараз дозволяє пацієнтам боротися з раком легень і є ефективнішим за хіміотерапію.
Таких прикладів з кожним роком стає все більше — кількість конвертується в якість.
Динаміка росту загальної кількості клінічних випробувань у світі, зареєстрованих на сайті clinicaltrials.gov
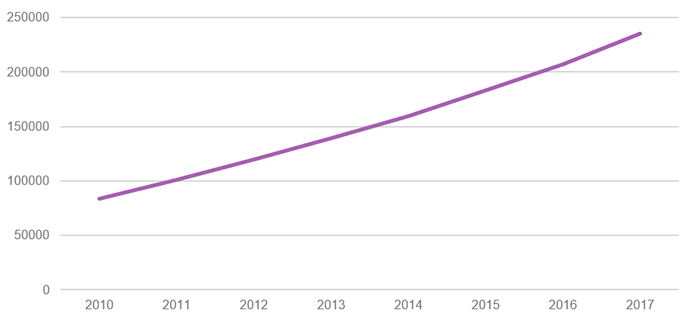
Чому країни прагнуть залучати до себе клінічні випробування
Клінічні випробування — це не лише допомога пацієнтам, а і суттєвий внесок в економіку країни. На їх проведення фармацевтичні компанії — спонсори досліджень — витрачають мільярдні кошти. Лише в ЄС розмір інвестицій, пов'язаних з проведенням досліджень, оцінюється в більше ніж 35 мільярдів євро на рік.
Значна частина цих коштів спрямовується на розвиток інфраструктури лікарень, навчання персоналу, закупівлю передового обладнання. Оплачуються послуги дослідницьких центрів, медичних лабораторій, логістичних та страхових компаній. Все це — реальні кошти, які потрапляють в економіку.
Вагомим внеском також є інтелектуальна складова — доступ лікарів до знань про інноваційні підходи в лікуванні захворювань, що в подальшому дає поштовх у наданні більш якісних медичних послуг.
Перелічені фактори пояснюють те, чому країни починають докладати все більше зусиль для залучення клінічних випробувань. Яскравим прикладом є Європейський Союз. За даними Єврокомісії, протягом 2007-2011 років кількість клінічних випробувань, що проводилися в ЄС, знизилася на 25%. Ключова причина — складність існуючих процедур, що призводило до затримки в отриманні дозволів на проведення досліджень та додаткові витрати спонсорів.
Для виправляння ситуації та сприяння припливу нових досліджень ЄС ініціював публічне обговорення з метою вдосконалення правил проведення клінічних випробувань, за результатами якого 2014 року було прийняте нове законодавство.
Кількість клінічних випробувань у США та європейському регіоні, зареєстрованих на сайті clinicaltrial.gov
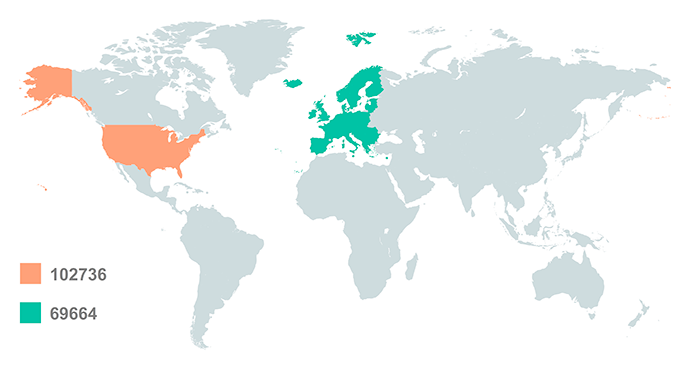
Які фактори впливають на залучення клінічних випробувань
Вибір країн, в яких буде проводитися дослідження, є надважливим стратегічним рішенням спонсора, від якого залежить успіх всього процесу.
Приймаючи рішення, компанії беруть до уваги багато факторів: поширеність певного захворювання на території країни, швидкість отримання дозволу на проведення дослідження та простота регуляторних процедур, потенціал для набору учасників дослідження, досвідченість дослідницьких центрів, якість даних, що збираються у ході дослідження, наявність конкуруючих досліджень та інші.
Для виведення препарату на ринок потрібно зібрати достатній обсяг даних про його ефективність та безпечність. Тому від того, чи буде включена у дослідження запланована кількість пацієнтів, прямо залежить успіх клінічного випробування.
Деякі спонсори докладають значних зусиль для залучення пацієнтів в дослідження: аналізують онлайн-форуми, на яких пацієнти обговорюють хвороби, з метою розробки дієвої реклами досліджень, організовують транспортування учасників дослідження до лікарні, зменшують обсяг паперів, які пацієнту потрібно підписати.
Проте ключовим у наборі пацієнтів все ж залишається потенційна кількість учасників дослідження у певному регіоні та успішність дослідницького центру у пошуку та залученні таких пацієнтів.
Дослідження не може бути розпочате без отримання дозволу на його проведення від компетентних органів. Час, необхідний для отримання такого дозволу, також впливає на вибір спонсора: країни, які дають дозволи швидко і без затримок, завжди в пріоритеті. У зв’язку з цим деякі країни приймають зміни у законодавство, встановлюючи мінімальні строки для розгляду заявок та надання дозволів, і надалі використовують це як свою візитну картку.
Терміни отримання дозволів у країнах Центральної та Східної Європи, у місяцях
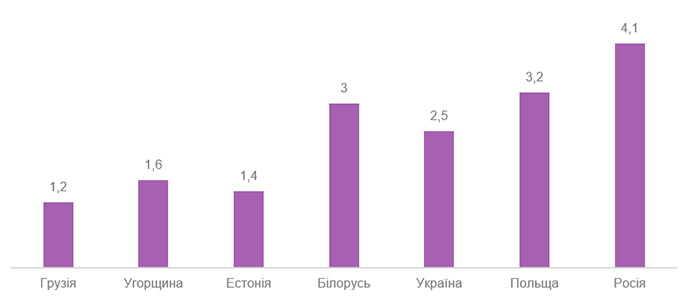
Джерело: firstclinical.com
Зібрані у ході клінічного випробування дані необхідно належним чином зафіксувати та обробити для передачі спонсору. Якість таких даних та відсутність помилок залежить від досвідченості дослідницьких центрів. Тому спонсори, зазвичай, віддають перевагу центрам, які вже залучалися до проведення дослідження. Чим більше у країні таких центрів, тим більша ймовірність цієї країни потрапити у дослідження.
Як вже згадувалося, проведення досліджень потребує значних витрат: виплати за страхування пацієнтів, оплата компетентним органам за оцінку заявок спонсорів на проведення досліджень, оплата послуг осіб, що залучені до проведення дослідження, інші адміністративні витрати. У кожній країні рівень таких витрат різниться, що також є важливим критерієм для спонсора.
В деяких країнах проведення клінічного випробування є обов'язковою передумовою для виведення лікарського засобу на ринок. Якщо спонсори зацікавлені у продажах своїх ліків на території таких країн, ці країни будуть залучені до проведення клінічного випробування.
Конкуренція за можливість провести клінічні випробування постійно зростає і у виграші залишаються лише ті країни, які докладають необхідних зусиль з метою покращення середовища для проведення досліджень.
Стан клінічних випробувань в Україні
Наша держава традиційно вважалася спонсорами привабливою територією для проведення досліджень з низки причин. Ключова з них — Україна, як правило, забезпечує високу кількість учасників дослідження. Це пояснюється, серед іншого, високим рівнем захворюваності населення у поєднанні з фактичною відсутністю безкоштовної медицини. Тому українські пацієнти є мотивованими брати участь у дослідженнях, де вони можуть отримати доступ до інноваційних препаратів та лікування за найкращими світовими стандартами.
Також спонсорами відзначається високий рівень підготовки наших дослідників – лікарів, що координують проведення дослідження. Це дозволяє забезпечити отримання якісних та точних даних про досліджуваний препарат. Те, що дослідження в Україні проводяться на високому рівні, неодноразово підтверджувалося у ході аудитів Управління продовольства та медикаментів (Food and Drug Administration) США.
Українське законодавство, яке регламентує проведення клінічних випробувань, загалом відповідає міжнародним практикам, а з огляду на підписання Угоди про асоціацію з ЄС можна очікувати подальшої гармонізації нашого законодавства з європейським.
Останніми роками також почала спостерігатися тенденція до скорочення строків погодження досліджень. Як зображено на графіку вище, за цим критерієм ми випереджаємо сусідні Білорусь, Росію та Польщу. Досить швидко відбувається і погодження та підписання договорів на проведення клінічних випробувань з залученими особами, що також є важливим показником для спонсорів.
Ще одним аргументом на користь України є нижча у порівнянні з, наприклад, західноєвропейськими країнами загальна вартість проведення клінічного випробування. Це пояснюється, зокрема, нижчою вартістю послуг, залучених до проведення дослідження осіб.
Та незважаючи на перелічені переваги, в останні роки кількість досліджень, що проводяться в Україні, почала зменшуватися.
Кількість клінічних випробувань, дозволених для проведення в Україні
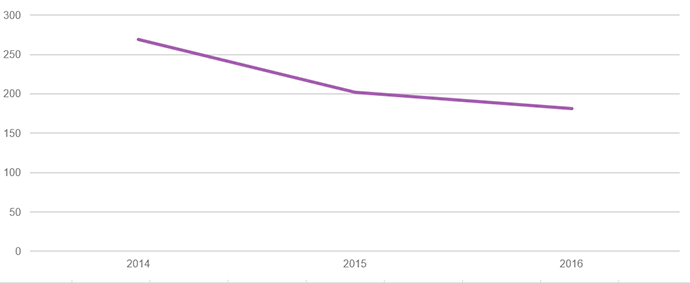
За даними Державного експертного центру МОЗ України
Це пояснюється як об'єктивними причинами, так і суто локальними факторами.
Серед об'єктивних — спонсори почали активно освоювати нові території — Африка, Південна Америка, країни Азії. Відповідно, конкуренція за потрапляння країн в дослідження зростає.
Серед локальних факторів, які, ймовірно, найбільше вдарили по кількості досліджень в Україні — анексія Криму та проведення Антитерористичної операції. З втратою контролю над значними територіями суттєво знизилися можливості для набору пацієнтів у дослідження. Також було втрачено багато дослідницьких центрів, а з ними — важливі для дослідження дані, ліки та обладнання. Щоб убезпечити себе від таких непередбачуваних обставин, спонсори почали розглядати альтернативні Україні варіанти.
Ще одним фактором, який ставить Україну в невигідне становище, є неадаптовані митні та податкові процедури. При ввезенні досліджуваного препарату на територію України митні органи часто визначають його вартість на основі ринкових цін на цей препарат чи його аналоги. Як правило, визначена вартість є досить високою і може сягати сотень доларів за упаковку препарату.
Виходячи з такої вартості, митними органами нараховується податок на додану вартість, який має бути сплачений при ввезенні. Однак для спонсорів такий підхід є незрозумілим і це не дивно. ПДВ за своєю сутністю є споживацьким податком, який застосовується у разі переходу права власності на товар в результаті його продажу. Та у клінічних дослідженнях препарати та інші матеріали завжди залишаються у власності спонсора чи його дочірніх компаній і, як правило, не мають певної вартості в силу їх відсутності на ринку.
Слід згадати, що кілька років тому ставку ПДВ для матеріалів клінічного випробування було знижено з 20% до 7%, що є позитивним кроком та фактично слугує підтвердженням їх особливого статусу. Та все ж ця зміна є лише напівзаходом і не знімає питання щодо обґрунтованості покладення цих додаткових витрат на плечі спонсорів.
---
Україна — одна з найбільш густонаселених країн Центральної та Східної Європи. Водночас, кількість досліджень, що у нас проводяться, наразі є чи не найменшою у регіоні. Для порівняння, у сусідній Румунії з менш ніж 20 мільйонів населення проводиться на третину більше випробувань. Різні джерела оцінюють, що потенціал України з проведення клінічних випробувань розкритий лише на 15 відсотків.
Що потрібно зробити, щоб розкрити цей потенціал? Яка формула успіху?
Перш за все, держава повинна почати проактивно працювати над створенням привабливого середовища для проведення досліджень. Це може бути досягнуто, зокрема, шляхом реалізації наступних заходів:
- скорочення термінів погодження досліджень;
- скасування ПДВ на досліджуваний препарат та інші матеріали дослідження;
- спрощення митних процедур при ввезенні матеріалів дослідження;
- гармонізація українського законодавства з європейським.
Все це сприятиме поверненню України на радари спонсорів.
Крім таких очевидних кроків Україні потрібно шукати свої візитні картки, що будуть вигідно виділяти нас з-поміж інших країн.
Зараз, наприклад, все більше спонсорів переходять на електронний документообіг, що дозволяє значно знизити витрати та прискорити процеси. Тому потрібно бути готовим відповідати цим новим запитам. Тут успіх значною мірою залежить від дослідницьких центрів, які повинні постійно вдосконалювати свої практики та йти в ногу з останніми тенденціями.

Створення окремої групи в МОЗ, яка буде працювати над створенням сприятливих умов для проведення досліджень та вирішенням поточних проблем у цій сфері, також може стати однією з таких візитних карток.
Звичайно ж, суспільство також не повинне залишатися осторонь. Наразі чи не єдиним активним поборником клінічних випробувань в Україні є профільний підкомітет Європейської Бізнес Асоціації, в актив якого можна записати чимало досягнень, що сприяли зростанню привабливості України для проведення досліджень.
Однак ідея залучення в Україну нових досліджень потребує більше прибічників. І якщо Україні вдасться досягнути цієї цілі – виграють всі. Економіка отримає інвестиції, лікарні — покращення інфраструктури, лікарі — доступ до інформації про новітні підходи у лікуванні.
Та найголовніше — багато пацієнтів отримають якісне лікування та шанс на одужання. А це, погодьтеся, варте того, щоб докласти зусиль.